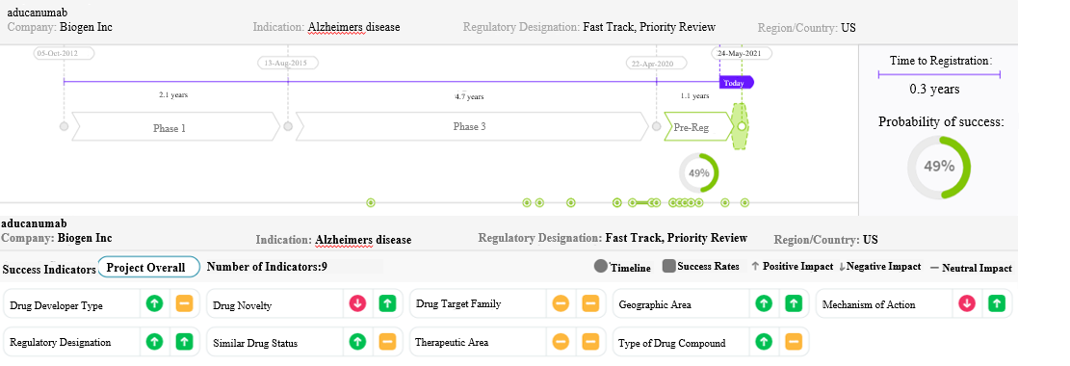
2021最值得关注的药物预测发表时间:2021-04-14 10:23 尽管2020年面临诸多挑战,最终药物研发还是取得了胜利。在已获批或即将获批的新药和生物制剂中,科睿唯安通过分析预测4种可能达到“重磅炸弹”级别的药物,预计每种药物在5年内的年销售额将超过10亿美元。这些最值得关注的药物包括:渤健和卫材制药联合研发的aducanumab;优时比研发的bimekizumab;武田研发的Relugolix;拜耳和默沙东联合研发的vericiguat。 Aducanumab (BIIB037) 神经系统疾病/精神疾病- 阿尔茨海默病 Aducanumab是由渤健和卫材制药联合研发的靶向β-淀粉样蛋白的重组嵌合人IgG1单抗。2020年8月,Aducanumab获得FDA优先审评资格;2020年11月,该药未通过FDA咨询委员会的审评,审评人员认为现有的临床试验证据无法证明该药物的有效性;申请人提交其他数据和分析结果后,处方药申报者付费法案(PDUFA)的目标审评日期延长了3个月至2021年6月7日。其标准上市许可申请(MAA)/新药申请(NDA)目前正在接受欧洲药品管理局(EMA)和日本药品和医疗器械管理局(PMDA)的审批。 阿尔茨海默病药物市场 全球约有5,000万阿尔茨海默病患者,由于人口老龄化,预计到2029年,早期阿尔茨海默病患者的总人数将增加30%以上。目前阿尔茨海默病仅为对症治疗:乙酰胆碱酯酶抑制剂(AChEI)和美金刚胺(现为仿制药)是轻度、中度和重度阿尔茨海默病患者的标准治疗药物。该病已有长达15年无新药获批,处于晚期研发阶段的其他主要抗β-淀粉样蛋白的改善病程治疗药物有lecanemab(BAN2401;卫材/渤健)和gantenerumab(罗氏),还有更多涉及多种作用机制(MOA)的药物(例如,tau蛋白靶向药物、sigma-1受体抑制剂以及SIGLEC3和Trem2抗体)目前正处于中期和晚期研发阶段。 患者始终迫切需求一种能够减缓认知功能减退且安全有效的改善病程治疗的药物,并亟需获得能够进行最早期诊断的工具。 市场预期 Aducanumab有望成为阿尔茨海默病(AD)首个改善病程治疗(DMT)的药物。在这个需求长期未得到满足并且同类候选药物经历了几十年失败后的市场上,该药可能成为一项里程碑級的成就,预计2025年Aducanumab的销售额将达到37.4 亿美元。 Aducanumab是首款在针对早期AD患者进行的III期研究中显示出临床疗效的改善病程治疗候选药物,也是首款提交了注册申请的改善病程治疗药物。从已终止的ENGAGE/EMERGE研究和已完成的PRIME研究获得结果表明,Aducanumab具有生物活性,在充分暴露于10mg/kg剂量时显示出潜在疗效。如果该药获批,将标志着该治疗领域在临床、商业化和药政方面取得了一项里程碑式的进展。然而,鉴于数据及其分析结果存在局限性,其注册申报数据包的内容复杂且存在争议。 注意:与审批相关的不确定性是主要因素。如果该药获批,市场准入障碍(成本/报销和临床应用/物流)将是影响其上市速度的关键因素。
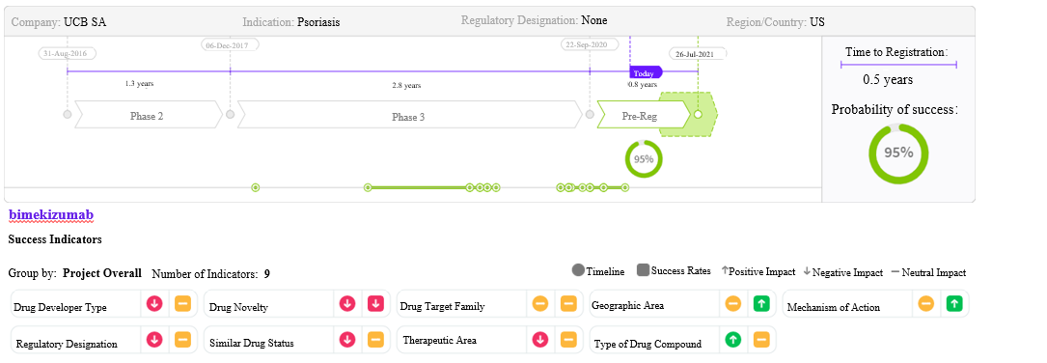
图1:基于Cortellis数据,预测aducanumab在美国获批的成功率为49% 来源:药物研发时程和成功率预测 (截至2021年2月10日的预测数据) Bimekizumab (优时比-4940;BKZ) 过度免疫应答/自身免疫性疾病 - 银屑病 Bimekizumab是优时比公司开发的一种人源化IgG1单克隆抗体,是首个进入III期研究,并且可同时靶向IL-17A和IL-17F的生物制剂。基于该药在3项III期研究的数据显示出优于安慰剂、乌司奴单抗(喜达诺)和阿达木单抗(修美乐)的疗效,FDA和EMA于2020年9月对该药的中重度慢性斑片状银屑病的适应症进行了审评。 银屑病药物市场 银屑病市场目前已经饱和,有生物和非生物制剂两类治疗选择,市场份额最大的银屑病生物制剂治疗药物包括以下几类:TNF-α抑制剂(通常作为一线治疗药物;修美乐,Embrel)、IL-12/IL-23(喜达诺)、IL-17(可善挺,Taltz)和IL-23(Tremfya,Skyrizi);目前的主要治疗药物有甲氨蝶呤(非生物制剂)。由于越来越多的证据表明IL-23和IL-17具有有效性,并且临床医生熟悉这些药物,这两类药物未来的市场份额可能会增加。 目前的生物制剂可暂时缓解许多患者的病情,但通常不会获得长期缓解。开发更优化的治疗选择,可使患者从新型有效和无类固醇副作用的外用药,以及安全有效性可与生物制剂媲美的口服制剂中获益。 市场预期 银屑病全球患病率约为2%-3%,Bimekizumab这种创新的银屑病治疗方法有望大大减少副作用,同时适度提高疗效,预计该药2025年的销售额将达18.6亿美元。 虽然Bimekizumab上市时间较晚,但其疗效优于既有的治疗选择。该药对IL-17A和IL-17F的双重抑制作用使其明显有别于其他生物制剂的MOA,且临床试验结果令人鼓舞。对于合并银屑病性关节炎的患者,Bimekizumab也可能使其中约30%的患者获益。 Bimekizumab可能作为三线或四线治疗药物,用于治疗无应答、未见缓解或其他药物可引起不可接受副作用的原发性银屑病患者。长期有效性和安全性对bimekizumab的使用至关重要。该药正在开发的其他适应症包括银屑病性关节炎(PsA)、强直性脊柱炎(AS)、放射学阴性中轴型脊柱关节炎(nr-axSpA)、溃疡性结肠炎和化脓性汗腺炎。 值得关注的是,bimekizumab的“重磅炸弹”地位可能受到IL-23抑制剂SKYRIZI(risankizumab)的上市及其新适应症PsA即将在美国和欧盟获批的影响。在同时面临IL-17类抑制剂激烈竞争的情况下,bimekizumab至少需要完胜3种同类竞品(布罗利尤单抗[Siliq]、依奇珠单抗[Taltz]和司库奇尤单抗[可善挺])才能在抑制剂中拔得头筹。
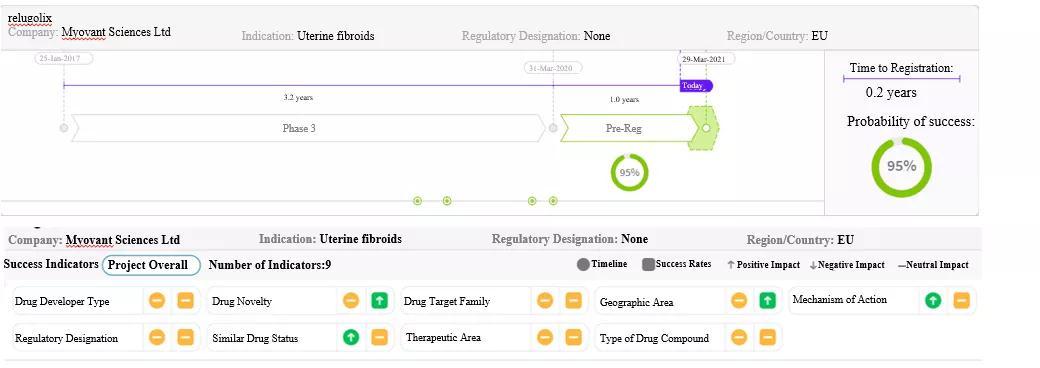
图2:基于Cortellis数据,预测bimekizumab将在美国首次获批 来源:药物研发时程和成功率预测(截至2021年1月14日的预测数据) Relugolix (TAK-385;Orgovyx;Relumina) 肿瘤领域 - 前列腺癌 生殖系统疾病 - 子宫内膜异位症和子宫肌瘤 Relugolix是由武田制药及其被许可方Myovant Sciences、辉瑞、ASKA Pharmaceutical以及Gedeon Richter公司共同开发的GnRH受体拮抗剂。 在治疗前列腺癌方面,2020年12月Relugolix在美国获批用于治疗前列腺癌,目前正在澳大利亚、巴西、加拿大、欧洲、日本、中国的大陆和台湾、新西兰、韩国进行多国/地区的III期(HERO)试验。在治疗子宫内膜异位症方面,该药正在澳大利亚、加拿大、日本、新西兰、南非、南美洲和美国进行III期试验。在治疗子宫肌瘤方面,Relugolix于2019年2月在日本获批用于治疗子宫肌瘤;其MAA/NDA申请正在接受EMA和美国FDA审批,与此同时,该药正在巴西、智利和南非进行III期试验。 前列腺癌药物市场 前列腺癌是全球男性第二大常见恶性肿瘤,预计2019~2029年间前列腺癌确诊人数的年复合增长率将达到1.5%,导致可使用药物治疗的患者人数增加。前列腺癌主要的一线治疗药物是雄激素剥夺治疗药物,包括睾丸切除术、GnRH激动剂和GnRH拮抗剂,这几种治疗方法可分别单独用药或与化疗、放疗或与雄激素拮抗剂联合使用;主要竞品有亮丙瑞林(GnRH激动剂)、费蒙格(GnRH拮抗剂);其他类型的药物还有化疗药物、免疫治疗药物、靶向骨转移药物和PARP抑制剂;处于晚期开发阶段、跨越多种类型药物(包括新类别)的动态产品管线,包括针对大量可使用药物治疗的激素敏感性前列腺癌和去势抵抗性前列腺癌(CRPC)的患者开发的、可为药物开发商带来显著获益的新型药物。 前列腺癌患者将从靶向具有新MOA的预测性生物标志物,并可预防或延缓前列腺癌进展为CRPC、且疗效更高的治疗药物中获益。 子宫内膜异位症药物市场 全球约有1,300多万名15~54岁女性已确诊患有或疑似患有子宫内膜异位症;在确诊为子宫内膜异位症的女性中,60%以上的患者接受药物治疗。药物治疗方面,艾拉戈克(Orilissa)是一种口服GnRH拮抗剂,是美国FDA2018年8月批准的首款也是唯一一款治疗子宫内膜异位症相关疼痛的药物;手术治疗方面,可选择切除或消融、子宫卵巢切除术。子宫内膜异位症相关疼痛的一线治疗药物有激素类避孕药和非甾体类抗炎药(NSAID),二线治疗药物有GnRH激动剂(例如,亮丙瑞林),大量接受药物治疗的患者是药物研发商研发新疗法的一个相当可观的目标人群。 对于子宫内膜异位症相关疼痛,目前很少有安全且可长期使用的药物,以及特别非激素类或非侵入性治疗方法。许多药物可引起不良的绝经期样副作用,如潮热、头痛和恶心。由于越来越多的女性将生育年龄推迟到中年时期,因此患者对保留子宫的治疗方法也有需求。 子宫肌瘤药物市场 全球约有50多万名20~54岁女性患有子宫肌瘤,子宫切除术是目前唯一确定能够治愈子宫肌瘤的方法,但也会导致患者永久丧失生育能力。Elagolix(Oriahnn)是2020年6月美国FDA批准的首款也是唯一一款治疗子宫肌瘤的GnRH拮抗剂。子宫肌瘤的基础治疗药物有激素类避孕药、GnRH激动剂、氨甲环酸、NSAID、亮丙瑞林和乌利司他(仅在欧洲上市);手术治疗选择有子宫切除术、子宫肌瘤切除术和微创手术,如子宫动脉栓塞、子宫内膜切除术和子宫内膜消融术。 目前很少有安全以及可长期使用的子宫肌瘤治疗方法,一旦停止治疗,肌瘤即可反弹性生长。目前患者可依赖的药物均为安全但疗效较差、有效但安全性不佳、或可引起类似绝经期副作用的药物。由于越来越多的女性将生育年龄推迟到中年时期,因此患者对保留子宫的治疗方法也有需求。 市场预期 对于几乎没有有效治疗选择的患者而言,新药很有可能对他们的临床结果和生活质量产生重大影响。尽管Relugolix在长期使用的女性患者中可引起雌激素水平降低的副作用,患者需要慎用并可能对副作用进行管理,但它仍是可供患者选择的有效口服药物。预期2025年的销售额达14.8亿美元。 Relugolix有望用于三种适应症,这可增加其研发成功的机会。与注射用(每3个月用药1次)GnRH激动剂的竞品相比,口服制剂(每日用药1次)更具优势,包括使用方便和副作用更容易管理。由于Relugolix已在临床试验中显示出有效性且相对安全,因此,它为使用药物治疗该病的患者提供了另一种治疗选择,患者可能无需手术治疗或可延迟手术治疗。 作为第二款在美国上市用于治疗子宫内膜异位症和子宫肌瘤的GnRH拮抗剂,Relugolix将与艾伯维研发的Orilissa/Oriahnn进行竞争,后者在2020年的总销售额为1.25亿美元。 尽管该药作为首款也是唯一一款获批用于治疗前列腺癌的GnRH拮抗剂,但面临来自已上市的GnRH激动剂和费蒙格(注射用GnRH拮抗剂)的激烈竞争,该药在前列腺癌市场的份额不会太大,并且仿制药替代品的进入将会进一步缩减其销售额。此外,虽然该药将首先在欧盟上市,但它的商业机会较小。 由于一线药物已在市场中形成稳固地位,同时临床医生因其潜在的长期副作用而不愿开具处方,该药的3种适应症可能需要较长时间才能占据市场。
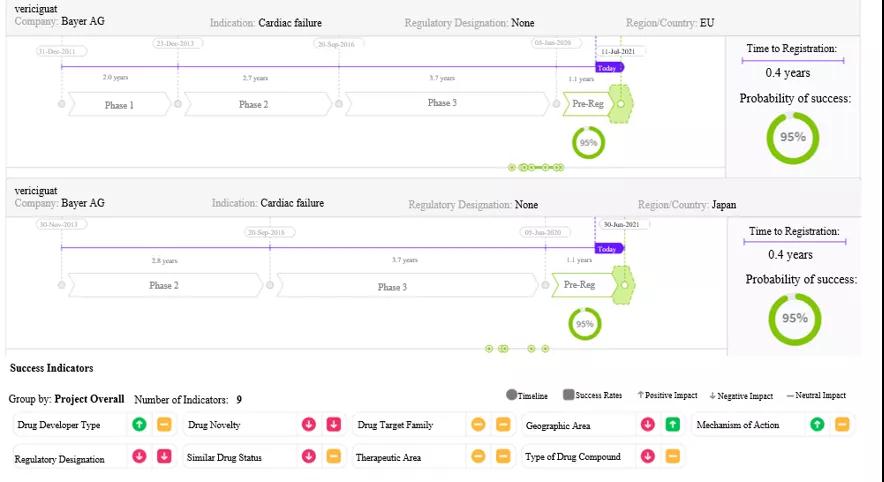
图3:Cortellis数据预测Relugolix将在欧盟获得第二次批准 来源:药物研发时程和成功率预测 (截至2021年1月26日的预测数据) Vericiguat ( BAY-1021189;MK-1242;Verquvo) 心血管疾病 - 心力衰竭 Vericiguat是由Bayer AG和默沙东公司共同开发的可溶性鸟苷酸环化酶刺激剂,该药2021年1月在美国获批的适应症是治疗因心力衰竭(HF)而住院治疗或接受门诊静脉注射利尿剂治疗后的成人慢性HFrEF患者,其MAA/NDA申请目前正在接受EMA、PMDA和中国国家药监局审批。 HFrEF药物市场 HFrEF市场中有多种有效的治疗选择,现已饱和且竞争激烈,提供差异化治疗是新上市药物获得成功的必要条件。最近获批用于治疗HFrEF的主要新药分别是2015年和2020年在美国获批的Entresto(沙库巴曲/缬沙坦)和Farxiga(达格列净)。 HF的死亡率、发病率和住院率仍较高。HFrEF病情恶化的患者发生再次住院治疗和死亡的风险最高,并且目前缺乏经评估后认为对该亚群患者具有特异性疗效的治疗药物。 市场预期 预计2030年美国的心力衰竭患病率将增加25%,30%的HFrEF患者将在3个月内再次住院接受治疗。这种新型药物是市场上首款专门针对射血分数降低(HFrEF)的慢性心力衰竭高风险患者开发的治疗药物,此类患者通常被排除在其他HFrEF治疗药物的临床试验之外。预计2025年该药的销售额将达12.1亿美元。 VICTORIAIII期临床试验结果表明,该药在重度HFrEF恶化患者中显示出住院率明显降低,心血管疾病死亡率也有降低的趋势,这使其在美国获批用于治疗HFrEF。对于这些患者而言,减少住院治疗和降低心血管疾病死亡率的需求仍未得到满足。由于Vericiguat的作用机制与既有的HF治疗药物存在差异,因此医生可将其作为附加治疗药物为患者开具,且产生严重副作用的风险较小。在慢性HF患者中,最常见的住院后治疗为换用不同药物或启用新药治疗,与病情稳定的患者应启用的药物相比,预计Vericiguat的市场份额将加速增长,尤其是考虑到其用药方便、每日1次口服给药和给药容易等特点。 而来自既有一线药物的竞争、目标患者人群有限以及支付方对报销政策的犹豫不决,则可能导致Vericiguat获得市场份额的进程缓慢,并影响其“重磅炸弹”地位。
图4:Cortellis数据预测,Vericiguat将同时在日本和欧盟获得第二次批准 来源:药物研发时程和成功率预测 (截至2021年1月26日的预测数据) |